 |
 |
 |
 |
  |
 |
ГХ МС Agilent и другие, особенности, о которых полезно зать |
 |
| timtima |
 9.03.2018 - 18:14 9.03.2018 - 18:14
Сообщение
#46 |
|
|
Здравствуйте. Вопрос может не совсем по теме форума, но самому не получается разрешить проблему и судя по ветке, экспертов хромотографии здесь предостаточно. Анализирую на Agilent 7890B в паре с QTOF 7200 образцы плазмы, ввод 1 мкл холодным сплитом 100 к 1 на PTV (изначально 70 градусов, с последующим поднятием температуры до 300). При построении кривой калибровки с помощью 6 стандартов различной концетрации сталкиваюсь с проблемой, что чем выше концетрация аналитов, тем сильнее сигнал (больше площадь пиков) у внутрениих стандартов (internal standards, IS) добавленных в одинаковом объеме и концентрации перед экстрацией. Растворитель - смесь аналитов 1:1:1 пиридина(MOX)/гексана/MSTFA. Лайнер со стекловатой, используется так же защитная колонка соединенная стеклянным пресс-фитом. Тоже самое в двух словах если получилось нечитаемо - чем выше изначальная концетрация "родных" веществ в пробнике, тем больше площадь у IS, хотя их я добавляю перед экстракцией в одном и том же объеме. Т.е. по логике и площадь у них должна быть одинакова. То что интенсивность сигнала ухудшается из за ионной интерференции это знакомо, но то чтобы он улучшался в несколько раз... При всем при этом линейность кривой калибровки достаточно хороша (R^2 зачастую больше 0,99). В первом столбце на картинке видна концентрация в 30 мкл, и в последнем столбце площадь IS. Спасибо за советы, если таковые появятся
Эскизы прикрепленных изображений |
 |
 |
| Deminolog |
 9.03.2018 - 20:03 9.03.2018 - 20:03
Сообщение
#47 |
|
|
Кхм... При одинаковых объемах конечной пробы и объеме вводимой пробы - такого быть не должно. А воспроизводимость одних и тех же точек какова?
Чаще всего такие ситуации возникают из-за того, что люди забывают о том, что концентрация внутреннего стандарта должна оставаться постоянной, на самом деле. |
 |
 |
| _EA_ |
 9.03.2018 - 21:40 9.03.2018 - 21:40
Сообщение
#48 |
|
|
|
 |
 |
| timtima |
 12.03.2018 - 11:20 12.03.2018 - 11:20
Сообщение
#49 |
|
|
Кхм... При одинаковых объемах конечной пробы и объеме вводимой пробы - такого быть не должно. А воспроизводимость одних и тех же точек какова? Чаще всего такие ситуации возникают из-за того, что люди забывают о том, что концентрация внутреннего стандарта должна оставаться постоянной, на самом деле. Конечный объем 75 мкл (у виалок дно V-образное, игла точно достаёт), инъекция 1 мкл. Воспроизводимость точек с одной и той же концетрацией аналитов в районе допустимых для меня значений, коэф. вариации +/- 10%. Анализирую полярные матаболиты (аминокислоты, жирные кислоты, различные сахариды и т.д.) Процесс экстракции: 30 мкл плазмы + 400 мкл метанола (содержит 4 внутренних стандарта); 30 мин на льду и центрифуга; 350 мкл супернатанта в новую виалку; испаряю весь супернатант под азотом до полной сухости; дериватизация в два шага (25 мкл MOX и 25 мкл MSTFA); перед ГХ добавляю 25 мкл со смесью алканов (для определения ретенционного индекса) и инъекционным стандартом. Я с русской номенклатурой могу сильно путать, т.е. внутренний стандарт в моем случае получается экстракционным. Площадь инъекционного стандарта всегда одинакова (разница менее 5%), а вот внутренних (экстракционных) стандартов различная. Т.е. проблема скорее всего не в самой ГХ, а в экстракции по ходу. Хотя не могу исключить, что и в PTV может происходить что-то странное. Там все таки сплит "не настоящий", а холодный при изначальных 70 градусах. Цитата Заколите серию одной концентрации и просто ВС, посмотрите, нет ли эффекта памяти. Нужно понимать где косяк, в хроматографии, или пробоподготовке. А что конкретно анализируете? При одинаковой концентрации все нормально, я пробовал и калибрационные стандарты и плазму, если делаю репликаты с одной концентрацией, то проблем как таковых нет. В плазме коэффициент вариации внутренних стандартов около 20-25%, что меня в принципе тоже устраивает. Так как анализ провожу для сравнения концентрации в двух различных группах (условно "здоровые" и "больные"). И разница в концентрации различных веществ в этих группах меня интересует в полтора и более раз. Я так же каждый шестой анализ делаю инъекцию чистого гексана и не разу эффектов памяти не было. Спасибо за помощь! |
 |
 |
| timtima |
 12.03.2018 - 18:18 12.03.2018 - 18:18
Сообщение
#50 |
|
|
И вот типичный пример на картинке. Разница по площади 100%, R^2 при этом >0.998.
Эскизы прикрепленных изображений 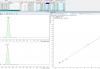
|
 |
 |
| Deminolog |
 12.03.2018 - 18:35 12.03.2018 - 18:35
Сообщение
#51 |
|
|
С терминологией все нормально, в этом плане мы друг друга спокойно и правильно понимаем, если будет удобнее на английском - тоже не проблема, поймем ;-)
Я ставлю на первый этап пробоподготовки. Плазма... Связывание с белком? Recovery оценивали на моделях? |
 |
 |
| timtima |
 13.03.2018 - 11:22 13.03.2018 - 11:22
Сообщение
#52 |
|
|
С терминологией все нормально, в этом плане мы друг друга спокойно и правильно понимаем, если будет удобнее на английском - тоже не проблема, поймем ;-) Я ставлю на первый этап пробоподготовки. Плазма... Связывание с белком? Recovery оценивали на моделях? Я калибрационные стандарты подготавливаю в метаноле. Изначально растворяю кристаллы чистых веществ в метаноле (1 мг/мл), ультразвук минут 5-10 и потом разбавляю до нужной концентрации соединяя в смесь из 50-60 веществ в метаноле. В стандарте с наибольшей концентрацией суммарная концентрация всех аналитов получается около 3,5 мг/мл, в наименьшем 4,5 мкг/мл. Потом беру 30 мкл каждого калибрацинного стандарта и делаю "экстракцию" по тому же протоколу, что и с плазмой. Recovery не оценивал, но метод экстракции можно сказать стандартный, без модификаций. Смотрел в трех различных источниках и в двух разных институтах видел сам "вживую", везде один и тот же метод и 80-120% извлечение. Единственная разница, что inlet у них как правило сплит/сплитлесс, а не PTV, ну и анализ не на высокого разрешения инструментах проводится (GCxGC-MS вместо нашего GC-QTOF). Звучит как в "бородатом" анекдоте про выигрыш в лоттерею, но в данном случае разница вроде не такая большая. В четверг надеюсь будет возможность поговорить с инженерами аджилентовскими, может что подскажут. Спасибо за советы, если получится разрешить вопрос, то отпишусь каким образом |
 |
 |
| out |
 4.04.2018 - 12:56 4.04.2018 - 12:56
Сообщение
#53 |
|
|
Здравствуйте! Не подскажите можно ли заменить G3169-65015 на G3170-65015(плата от 5973 на плату от 5975)?
|
 |
 |
| KSS17 |
 4.04.2018 - 18:19 4.04.2018 - 18:19
Сообщение
#54 |
|
|
Здравствуйте!
Здравствуйте! Не подскажите можно ли заменить G3169-65015 на G3170-65015(плата от 5973 на плату от 5975)? Чё-то подозреваю, что нет. Sideboard PCA, fast electronics, for gas chromatography/mass spectrometry analyzers, used with series 5973, systems 5973A, 5973N and 5973inert Sideboard PCA, for gas chromatography/mass spectrometry analyzers, used with series 5975 and 5977, systems 5975A, 5975B, and 5975C |
 |
 |
| RedPepper |
 19.09.2023 - 09:47 19.09.2023 - 09:47
Сообщение
#55 |
|
|
|
 |
 |
| tihonya |
 13.03.2024 - 15:04 13.03.2024 - 15:04
Сообщение
#56 |
|
|
Добрый день!
Кто может поделиться прошивкой на Agilent GC 7820A , чтобы работала под MassHunter B.07.02. На приборе установлена A 01.12.005. Последние прошивки A.01.18.003-A.01.18.007 не пошли - программа не видит ГХ. |
 |
 |
  |
| Сейчас: 15.01.2025 - 09:50 |
© 2002-2017 Форум судебных медиков России
Копирование материалов сайта возможно при условии размещения активной ссылки на источник.
Копирование материалов сайта возможно при условии размещения активной ссылки на источник.









